京卫计网审[2015]第0523号 京ICP备14051922号 京ICP证160408号
京公网安备 11010502030806号 Copyright © 2014 北京易康医疗科技有限公司版权
发布时间:2016-08-19 | 来源: | 责任编辑:嗵嗵e研

临床试验中应有明确的研究假设这一点咱们大家都有共识,由于随机对照试验设计(RCT)通常是用于验证某个科学规律,因此除了要有明确的研究假设,还需要提出一个明确的统计假设,比如我们和大家分享过的等效、非劣效和优效,这其实就是统计假设的范畴。如果说确定等效、优效、非劣效还是相对简单的抉择,那么难的是如何确定无临床意义的界值。我们来感受一下,下图中,无论是等效性、优效性还是非劣效性的假设均需要设定Δ。那么Δ是什么呢?
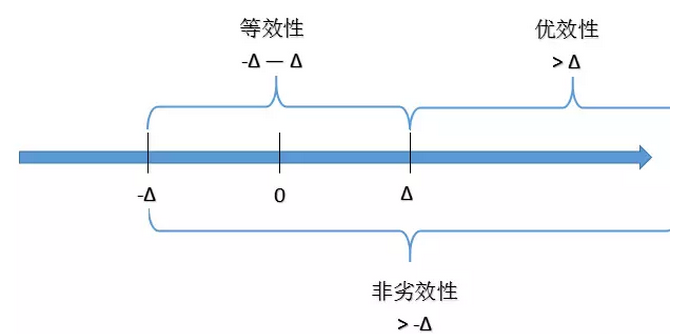
Δ其实就是:药效间不具有临床意义的最大允许差异值,也就是超过了这个界限,我们就可以认为两组间的差异足以指示临床的优劣。这个Δ取多大非常重要,假设我们做的是一个新药注册的临床试验,如果Δ太大,会把疗效远不如对照药的药物判断为非劣效或等效,从而让疗效并不太好的药物上市;而若Δ太小,则可能把本来可以推广有效药物误判为无效而埋没了确实有临床疗效的药物。那么,Δ该定多大呢?
MCID的概念是不是和Δ很相近呢?一个是最小临床意义变化值,另一个是最大无临床意义的差异值。其实,如果在本疾病的研究领域中,有人做过MCID(有时也叫MIC,Minimalimportant change)的相关研究,那么直接套用相关研究的结果来确定临床试验中的Δ即可。目前MCID的测量和确定多数局限在量表领域,如生活质量、神经功能评价、某些干预后VAS评分等等。但依然有大量以其它终点评价指标并没有MCID的相关研究支持。那么,在没有文献或研究支持时,如何确定Δ呢?
ICH(International Conferenceon Harmonization of Technical Requirements for Registration of Pharmaceuticalsfor Human Use,人用药品注册技术要求国际协调会)和EMA(European medicines agency,欧洲药品管理局)对于非劣效假设有两条指导原则:
1. 试验药物(A)的疗效要优于安慰剂(P)以保证药物的有效性(A-P>0);
2. 试验药物(A)的疗效又要好到不差于阳性对照药(B)(A-B>-Δ)
但大家看到这两条原则是不是更晕了?本来还只是两个药物头对头(head to head)的比较,现在还有个安慰剂掺和进来,更乱了,有没有?不过从这两条原则里我们还是能看到Δ的一点点端倪。也就是Δ不能大于B-P,就是阳性对照药的疗效与安慰剂疗效之差。这个确定Δ的方法依然受到了很多人的诟病,难道,试验药物只要比安慰剂好就可以认为它不比阳性对照药差了么?
确实,如何确定Δ一直以来是存在争议的,可能对于希望药物尽快上市的群体,希望这个界值能定得宽松一些,这样可以减少临床试验的样本量,加快药品上市的进程。而对于希望确保新药有确切疗效的群体,可能就会倾向于把Δ值制定得相对小一些。目前常见的观点如下:
对于定量的疗效评价指标,可以选择疗效指标的1/5至1/2的标准差,或者阳性对照药物疗效评价指标均值的1/10到1/5之间。而对于疗效指标是相对数(率或比),那么Δ不应大于阳性对照组样本率的1/5。
举个例子,如果要比较A药(试验药)和B药(对照药)的降压效果,当疗效评价指标是规律服药半年后的平均动脉压水平时,假设B组患者的平均动脉压是110±20,Δ可以定为4-10之间(B组标准差的1/5至1/2),也可以是11-22之间(B组血压均值的1/10到1/5)。如果疗效评价指标是血压的控制率,假设B组的血压控制率是80%,那么Δ可以定为小于16%(阳性对照组样本率的1/5)。
当然以上对于Δ的推荐都是原则性的,在研究设计阶段,如何制定Δ需要经过反复的论证和审慎的考虑,同时要参考具体研究领域中的行业标准以及实际需要和研究的可操作性。目前往往会通过组织相关领域的临床专家经过细致的研讨并达成共识。
京卫计网审[2015]第0523号 京ICP备14051922号 京ICP证160408号
京公网安备 11010502030806号 Copyright © 2014 北京易康医疗科技有限公司版权